代谢组学在肿瘤研究中的应用
次阅读

癌症对生物代谢的影响不仅包括正常组织代谢的改变,还包括肿瘤微环境中细胞内代谢的重新编程。FDG-PET扫描是许多癌症管理的重要工具,而代谢是癌症诊断、监测和治疗的重要方向。代谢组学是对小分子代谢物的全面分析,与其他组学相比能够得到更多疾病的关键信息。
迈理奥为大家分享一篇2021年发表在A Cancer Journal for Clinicians杂志(IF=508.70)的文章,该文章综述了在细胞、组织和系统水平上癌症及癌症治疗与代谢间的相互作用,重点介绍了目前的代谢组学技术及其在临床和转化研究的应用情况。

文章题目:Metabolomics in Cancer Research and Emerging Applications in Clinical Oncology
发表期刊:A Cancer Journal for Clinicians (IF=508.70)
发表时间:2021
癌症能够改变癌细胞和正常组织的代谢,随后通过与内、外因素相互结合,导致系统代谢受到影响。癌细胞代谢重编辑造成的代谢表型特征可用于早期癌症诊断、临床试验病人策略选择,以及作为治疗评价的生物标志物。癌症及癌症治疗与饮食、运动的代谢效应相互作用,可能会对癌症结果及患者的生活质量造成影响。代谢变化的传统评估技术大多局限于影像学方法和标准的临床实验室测试,代谢组学与传统评估技术相比,涵盖更全面的代谢物信息,如营养物质、药物、信号介质,以及在血液、尿液、组织或其他体液中的小分子代谢产物等(图1)。
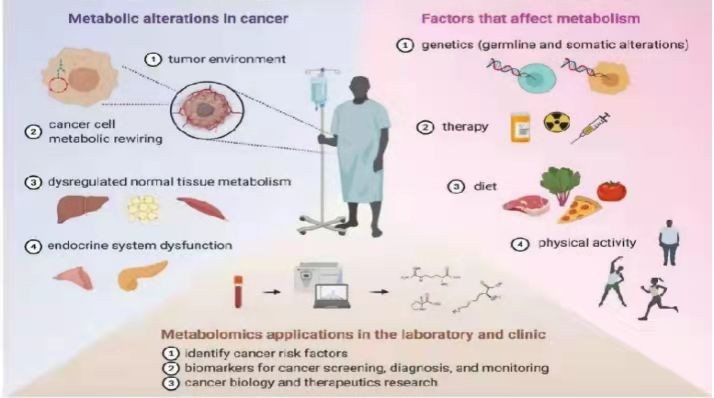
图1 在细胞、组织和个体水平上代谢和癌症的相互作用
1.癌细胞代谢
癌细胞中最早和公认的代谢变化观念是葡萄糖的消耗会增加。多个研究表明,癌症能够通过多种机制影响葡萄糖代谢。由胰岛素或其他生长因子诱导的受体酪氨酸激酶能够激活PI3K-AKT信号通路从而刺激糖酵解。PI3K- AKT信号诱导哺乳动物合成mTORC1 导致HIF1α 表达量增加。在缺氧条件下,PI3K- AKT信号可稳定HIF并激活GLUT1和GLUT3、HK2、磷酸果糖激酶2 的表达,HIF1α的一些亚型也促进丙酮酸脱氢酶激酶的表达,抑制丙酮酸氧化,并将糖代谢向乳酸分流,使细胞能够适应缺氧胁迫。除葡萄糖外,其他营养物质的吸收增加也可以促进癌细胞的生存、生长和侵袭。研究表明致癌的MYC与谷氨酰胺分解增加有关,MYC也可以调节脂肪酸代谢。
总之,代谢通路和信号通路之间存在着多重复杂的相互作用导致代谢重编程是癌症的一个基本标志。内在因素(基因组/表观基因组改变)和外部因素(营养物质、药物、激素以及与基质细胞、细胞外基质和免疫系统的相互作用)都有助于癌细胞的代谢重编程。
2.靶向代谢的癌症疗法
核苷酸合成小分子抑制剂是多药化疗方案的主力,如二氢叶酸还原酶、胸苷酸合成酶抑制剂、焦磷酸磷酸核糖酯酰胺转移酶抑制剂、核苷酸还原酶抑制剂以及参与嘌呤和嘧啶合成酶抑制剂(表1)。除了靶向核苷酸和DNA合成外,早期癌症治疗还针对其他代谢通路(包括糖酵解、谷氨酰胺代谢、氨基酸运输和生物合成、线粒体代谢、脂质代谢以及癌症中突变的酶)(表1)。例如,有研究发现急性淋巴细胞白血病细胞依靠外源性天冬酰胺进行生长,因此使用细菌酶左旋门冬酰胺酶能有效抑制白血病细胞生长。

3.癌症的系统代谢效应
体重减轻与厌食症是癌症常见的临床表现,但目前引起此种情况的机理尚不清楚。癌症恶病质的特征是骨骼肌衰减、瘦体质量和脂肪丢失。有研究表明大量循环因子(包括细胞因子、神经肽、类二十烷类和肿瘤来源的蛋白)与恶病质的发病机制有关,并且其潜在的病因可能是多因素的。癌症恶病质和体重减轻也与系统代谢改变有关,主要归因于肿瘤诱导的宿主代谢变化,而不是肿瘤本身的代谢活动。此外研究表明,在一些癌症患者中能观察到静息能量消耗的增加现象,这表明代谢亢进可能是导致某些癌症消瘦表型的特征。
通过手术、放疗、全身治疗或激素治疗癌症不仅会引起急性反应与长期的副作用,同时还会影响代谢。在接受头颈部和胃肠道恶性肿瘤化疗的患者,可能由于恶心、呕吐、腹泻、粘膜炎和味觉失调引起营养不良和体重减轻。研究结果表明,化疗对能量消耗影响程度普遍偏低,但接受化疗的患者在治疗期间代谢功能减退。如头颈部和肺癌放疗患者的葡萄糖、脂质或蛋白质代谢没有显著差异。而软组织肉瘤的联合治疗(手术、放疗和化疗)有显著的急性营养效应,而治疗后无病患者的营养发病率很低。此外,激素治疗对乳腺癌和前列腺癌患者的矿物质和脂质代谢具有长期的影响。
5. 饮食和生活方式因素在致癌作用和治疗反应中的作用
理论上说,膳食成分可以影响营养循环和代谢激素,可能会直接影响肿瘤细胞内的代谢。饮食和生活方式的因素除了影响癌变外,也可能影响癌症的治疗。一些研究表明,饮食对肿瘤进展的影响可能源于肿瘤遗传学和肿瘤微环境。如,胰岛素生长因子(IGF)信号通路与许多热量限制研究有关,但直接激活IGF只能部分逆转热量限制对肿瘤生长的影响。此外,低热量、低蛋白饮食改善了乳腺癌化疗患者肿瘤的客观疗效。而在动物模型中,通过热量限制和其他饮食干扰造成IGF信号传导、氧化应激和核苷酸代谢的代谢产物特异性的影响,从而改变化疗和放疗的疗效。
代谢组学因为能提供代谢过程的功能信息并直接评估表型,从而有别于其他组学(图2)。代谢产物是生物信息传递的终端,代谢产物变化能够反映代谢应答的全貌和动态变化过程. 因此代谢组学能够真实反映生物体的整体信息。
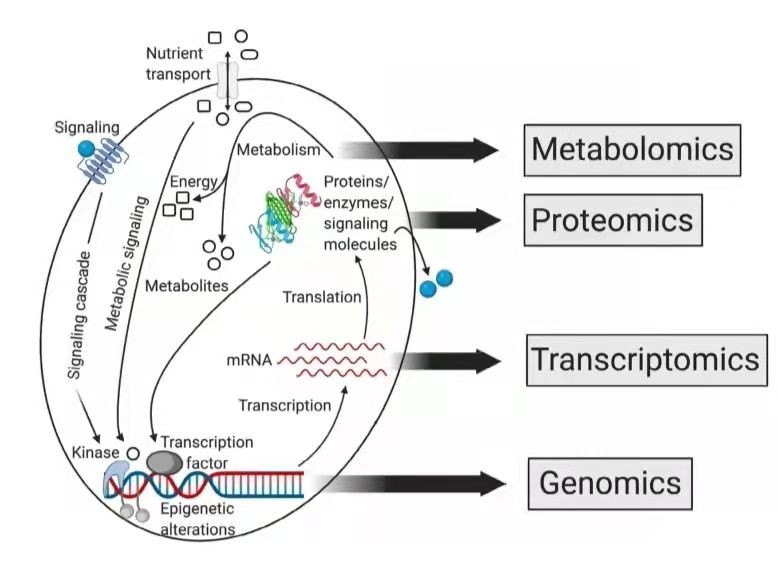
图2 系统生物学中各组学之间的关系
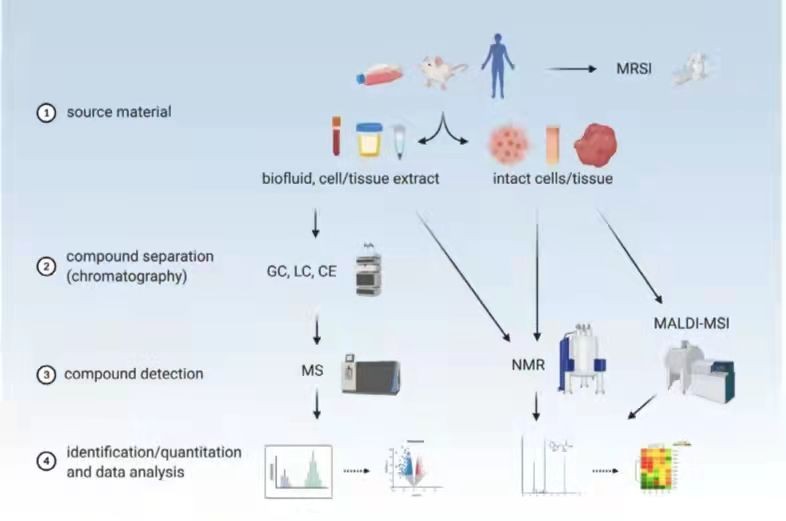
图3 代谢组学的主要技术
2.可分析的样本类型
代谢组学旨在利用癌症的代谢特征来评估疾病风险、早期癌症检测、特定疾病亚群诊断he和治疗监测。原则上,代谢组学也可能有助于合理选择与癌症代谢依赖相匹配的靶向治疗方法。
1.确定癌症风险因素
人们普遍认为,恶性肿瘤与基因突变的持续积累相关。环境因素通过诱导体细胞DNA 改变和选择转化细胞来促进肿瘤的发生过程。炎症因子和代谢因素通过诱导活性氧间接促进肿瘤的发生和创造一个选择致癌突变和表观遗传改变的环境。此外,代谢的改变会影响染色质动力学和促使肿瘤发生表观遗传变化。
多项研究表明,基于诊断前血清进行代谢组学分析能够更好地揭示代谢物与癌症风险之间的关系。如对乳腺癌患者循环代谢物分析表明,酰基肉碱、磷脂酰胆碱与乳腺癌的风险密切相关,而这与乳腺癌的亚型、年龄、禁食状态、绝经状态或肥胖无关;同样,较高的循环溶血磷脂酰胆碱与较低的乳腺癌、前列腺癌和结肠直肠癌的风险相关;此外首次发现与与咖啡摄入量相关的血清代谢物是前列腺癌、肺癌、结肠直肠癌和卵巢癌(PLCO)早期筛查的生物标志物,同时发现某些咖啡因相关的代谢物与结肠直肠癌呈负相关。
2.识别癌症筛查、诊断和监测的生物标志物
癌症检测技术不仅对初始诊断至关重要,而且还为筛选合适人群、指导初期治疗策略、评估治疗疗效、追踪癌症进展等提供有效途径。成像技术被广泛应用于临床的癌症检测和随访,FDG-PET是最早用于癌症检测的方法之一。但PET成像技术具有一定的局限性,如放射性示踪剂的可用性有限和半衰期短,图像分辨率差,无法检测较小的肿瘤,以及无法区分肿瘤的非恶性高代谢过程等。
直接分析临床标本和生物液体中的代谢物与代谢成像相比,具有提高可监测的化学物种的敏感性和多样性的优势。研究表明,临床标本中的代谢信息可用于明确潜在的生物标志物。如通过分析肿瘤组织、血浆和尿液,确定肌氨酸是前列腺癌的潜在生物标志物;在肿瘤组织和血清中,乳酸和谷氨酸可以用来评估疾病的侵袭性。此外,大量基于生物液体代谢确定的癌症潜在生物标志物研究,如4种代谢物(l-辛烷酰肉碱、5-氧脯氨酸、次黄嘌呤和二十二碳六烯酸)被鉴定为乳腺癌潜在的血清生物标志物;牛磺酸水平可作为膀胱癌潜在尿液生物标志物。
3.发现干扰癌症代谢的靶向疗法
代谢物水平的变化反映了癌细胞中代谢酶的活性,因此可用于帮助识别基因与蛋白水平造成的细胞活性功能改变。多种研究表明,肿瘤代谢物 D-2-HG在癌细胞中显著升高,D-2-HG 改变染色质修饰酶的活性并促进疾病进展,这促使了靶向突变 IDH 药物的开发。
尽管目前代谢组学与其他组学相比应用较少,但它对肿瘤学的筛查、诊断和治疗等核心区域可能会产生重大影响。而对于临床上容易获得的生物液体(尤其是血浆),具体哪些代谢物能够反映癌症状态的研究还处于早期探索阶段。在含有癌症的液体中进行代谢组学实验并将这些测量结果与肿瘤的代谢和生物学联系起来的研究是一个很有前景的新方向。
代谢组学面临的挑战之一是代谢物的庞大数量和化学复杂性。例如,血浆代谢物的组成是肝脏、肌肉等器官水平代谢、膳食摄入、微生物活性等多种因素的综合表现。我们认为,结合其他组学技术和假说驱动来发现癌细胞功能的改变研究是代谢组学的最佳应用。我们预计,随着标准化的协议、平民化的仪器和便捷的分析平台,代谢组学将在临床诊断和预后监测中发挥越来越重要的作用。
迈理奥DeepMarker MT代谢组学平台
平台采用全球领先的高效化学同位素标记(HP-CIL)技术和国际前沿的LC-HRMS仪器设备,并通过全套优化的具有自主知识产权的IsoMS Pro软件进行数据分析:颠覆式的技术创新突破了常规代谢组学方法的瓶颈,体现了全方位、多层面的领先优势。
版权所有 © 厦门市迈理奥科技有限公司 All rights reserved 闽ICP备2021011510号-1 技术支持:厦门市迈理奥科技有限公司
联系我们
联系方式:0592-6882803
邮箱:
mlo_service@meliomics.cn




迈理奥客服
迈理奥公众号


迈理奥视频号
迈理奥哔哩哔哩号

地址:
福建省厦门市海沧区翁角西路2052号(厦门生物医药产业园)B2栋703室

