先天性代谢缺陷筛查:非靶向代谢组学方法优于传统筛查方法
次阅读

临床上,常用代谢小分子的生化检测对先天性代谢缺陷(IEMs)进行筛查,与这种传统的筛查方法相比,非靶向代谢组学分析方法检测的代谢物覆盖率更高,是否具有更高的IEMs的诊断价值?
迈理奥为大家分享一篇发表在JAMA Network Opens杂志(IF=8.485)的文章,该文章证明了非靶向代谢组学分析方法作为IEMs筛查工具的优越性和实用性。

发表时间:2021年
先天性代谢缺陷(Inborn Errors of Metabolism,IEMs)的标准诊断方法为:症状识别、常规实验室检测以及生化和/或基因检测。临床上,从新生儿到成年晚期的不同时期均可能出现多种急性到慢性的IEMs临床表现形式,几乎涉及人体的各个组织或器官,因此这些非特异性后遗症常给诊断带来挑战。虽然面临诸多挑战,但许多IEM是可以被治疗的,因此,IEM的早期检测和诊断的重要性不言而喻。新生儿筛查(NBS)作为IEMs的第一道评估防线,旨在筛查伴有严重代谢性疾病的新生儿,有利于改善新生儿终身健康结果。
传统的代谢筛查方法是采用色谱质谱技术对血浆氨基酸(PAA)、血浆酰基肉碱(ACP)和尿有机酸(UOA)这三种物质的生化分析。NBS以这三种物质的分析结果作为43种IEMs的标准。由于串联质谱技术的进步,NBS内容得到了扩展,目前有49种代谢疾病(包括25种核心疾病和24种次要疾病)被列入标准的一线筛查组(RUSP)。然而,在RUSP表并未包括所有的IEMs类型,因此,即使NBS检查结果正常,仍需要对有IEMs病体征和症状的个体进行进一步检测。
本次研究比较了两个不同队列的数据:一个是4464份临床样本的传统代谢筛查队列(进行临床生化检测的1483个不相关家庭的1488名连续患者的样本),另一个是2000个临床样本代谢组学筛查队列(通过非目标代谢组学分析评估的来自1807个不相关家庭的血浆样本),其中包括也通过传统筛查方法分析的158个家庭。图1为 IEMs筛查的研究路线图。
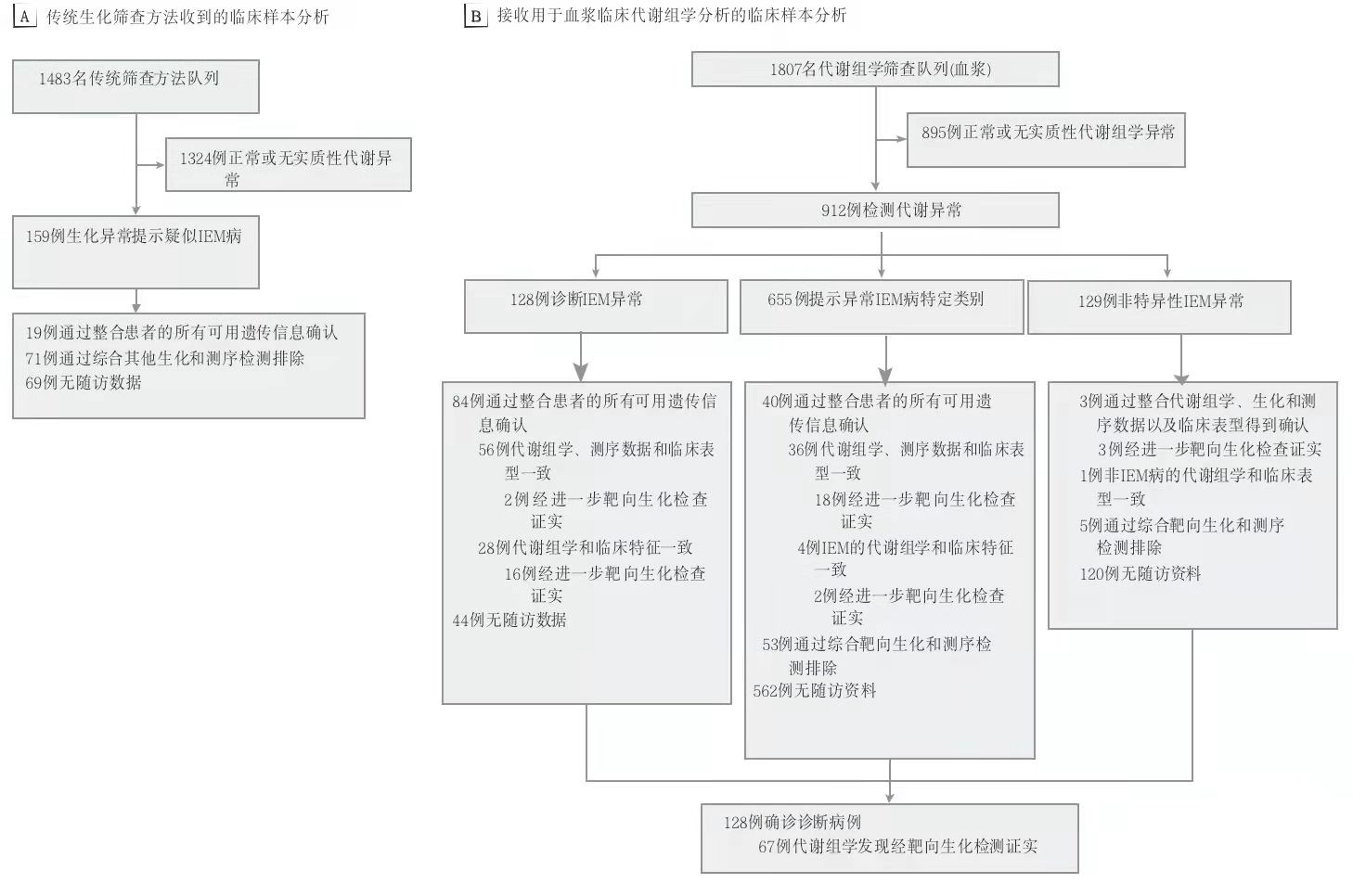
图1 IEMs筛查的研究路线图
注:A 筛查的临床样本的传统生化分析。2014年6月至2018年10月期间转诊接受传统筛查方法(包括血浆氨基酸、尿有机酸和血浆酰基肉碱的检测)的患者,并评估了所有相关患者数据。数字代表不相关的家庭.
B 血浆样本的非靶向代谢组学分析。评估了2014年7月至2019年2月期间转诊的患者,以提供全面和深入的分析。数字代表独特的、不相关的家庭。IEMs表示先天性代谢缺陷。
采用传统方法筛查的1483例患者,包括912例男性(61.5%)和1465例儿童 (98.8%)。其中,159例生化异常的病例中有19个家庭患有(11.9%)为IEMs,最终诊断率为1.3%(1483例中有19例),而非IEMs的患者有71例(44.7%),其余69例(43.4%)缺乏其他有用的信息进行确诊。本方法共鉴定出14种IEMs,除L-2/D-2-羟基戊二酸尿症、高胱氨酸尿症、巨幼细胞性贫血、CBLG型和乙基丙二酸脑病外,有11种(78.6%)在RUSP表中,包括7种核心疾病所涵盖的疾病和4种RUSP继发性疾病所涵盖的疾病,因此,RUSP表中未包含的 IEMs,仅有 0.2%的诊断率。
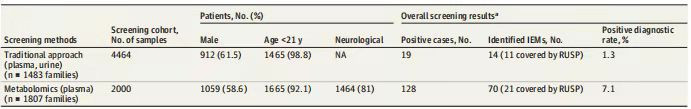
表1 队列人口统计学特征以及临床代谢组学与传统代谢筛查方法的诊断率比较
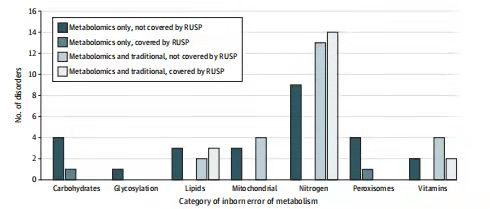
图2 血浆临床代谢组学与传统代谢筛查和新生儿筛查(NBS)筛选的代谢疾病比较
研究发现,非靶向代谢组学的分析方法与传统筛查方法相比,能够检测到更多IEMs类型、具有更高的诊断筛查率(约高6倍),并且识别了许多未纳入NBS的疾病。随着美国各州新生儿筛查的覆盖范围的扩大,需要更广泛的IEMs初筛方法。例如采用非靶向代谢组学或一系列代谢物的靶向分析,有利于IEMs患者的更全面地早期评估,尤其包括智力残疾、癫痫发作、整体发育迟缓或自闭症谱系障碍在内的神经表型的初始评估。此外,临床代谢组学也可为IEMs提供了广谱功能性筛查,从而实现全面的遗传诊断方法。
平台采用全球领先的高效化学同位素标记(HP-CIL)技术和国际前沿的LC-HRMS仪器设备,并通过全套优化的具有自主知识产权的IsoMS Pro软件进行数据分析:颠覆式的技术创新突破了常规代谢组学方法的瓶颈,体现了全方位、多层面的领先优势。
扫描二维码即可阅读原文

版权所有 © 厦门市迈理奥科技有限公司 All rights reserved 闽ICP备2021011510号-1 技术支持:厦门市迈理奥科技有限公司
联系我们
联系方式:0592-6882803
邮箱:
mlo_service@meliomics.cn




迈理奥客服
迈理奥公众号


迈理奥视频号
迈理奥哔哩哔哩号

地址:
福建省厦门市海沧区翁角西路2052号(厦门生物医药产业园)B2栋703室

